単元 水溶液の性質
目標 水溶液には金属を入れると金属が溶けて気体を発生させたり、金属の表面の様子を変化させたりするものがあることを捉えられるようになる。
観察・実験
【事象提示】「酸性の温泉でシルバーネックレスが変色」「酸性雨で銅像が変色」
⇒ 酸性の水溶液は金属を変化させるのだろうか?
【問題】「水溶液には金属を変化させる働きがあるのだろうか」
【予想】酸性の水溶液は金属を変化させると思う、酸性の危険な洗剤もある、など
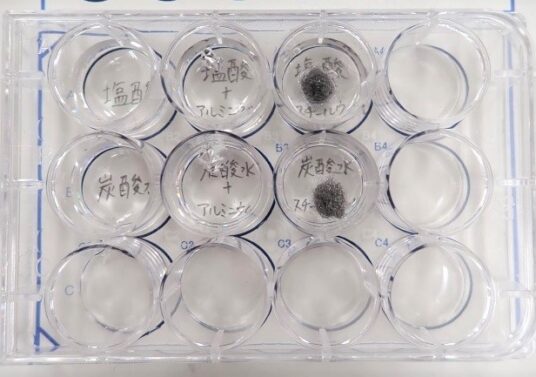
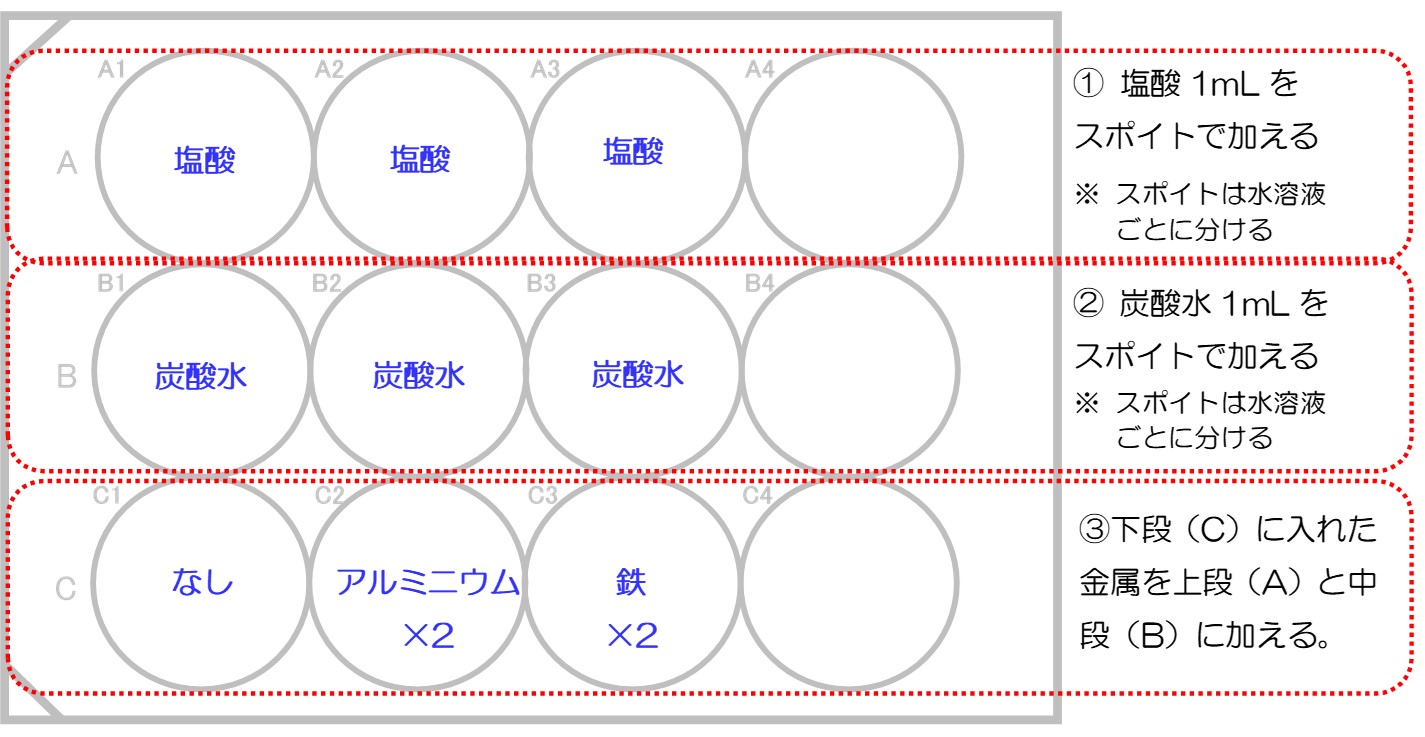
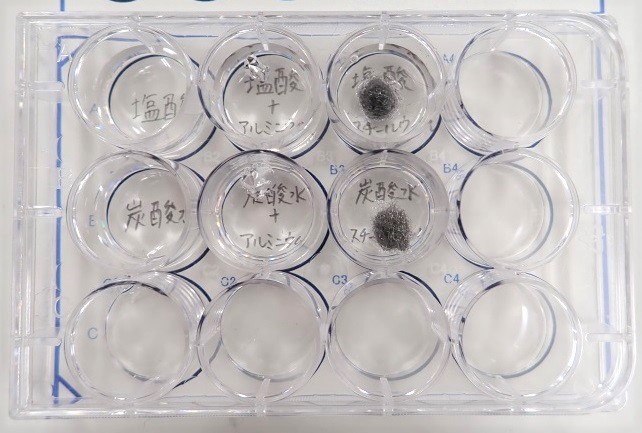
【実験】12穴プレートを下敷の上に置き、アルミホイル、スチールウールを下段(C)に2個ずつ入れる。
【結果】塩酸 ⇒ アルミニウムや鉄が溶けた。炭酸水 ⇒ アルミニウムや鉄は溶けなかった。
【考察】・溶けた金属はどうなったのだろう? ・溶けた金属は取り出せるのか?
【結論】「水溶液には、金属を溶かすものがある」
豆知識
- 市販の塩酸は12 M (mol/L)なので、3~6 M (1/4~1/2)程度に希釈して使用する。
- 塩酸とアルミニウムの反応では、目に見えて反応が開始するまで数分かかることがある。表面の酸化膜を紙やすりで除くと速くなる。気温が低い時は、少し温めると速くなる。反応がはじまると、容器が熱くなるので注意する。
- アルミニウムの激しく泡を出してなくなる様子と、鉄のゆっくり泡が出続ける様子を同じ「溶ける」と捉えづらい児童もいる。時間をおくとどうなるのか(鉄も数時間から数日で見えなくなる)など考えさせるとよい。
- 塩酸への金属の溶解はイオン化傾向(K,Ca,Na,Mg,Al,Zn,Fe,Ni,Sn,Pb,(H),Cu,Hg,Ag,Pt,Au)で説明できる。水素よりイオン化傾向が大きいもの(左側)の金属は溶ける。
- 多穴プレートは、少ない量の試薬で実験することができる。また複数のウェル(穴)で実験することで、実験結果を比較しながら観察することができる。もともとは細胞培養等に使われるものだが、現在はマイクロスケール実験用として「マイクロプレート」「セルプレート」の名前で、教材会社などでも入手可能である。

注意事項
・実験は安全メガネを着用して行う
・塩酸がついたときには、すぐに洗う・終了後は必ず手を洗う
・目に入った場合は水で数分間注意深く洗い、コンタクトレンズは外して目の洗浄を行う
・廃液は適切に処理をする




 実験レポ 9件
実験レポ 9件

実験レポ
塩酸と炭酸水を一度にできるのは とてもよい。試験管立ては、倒したり、運ぶとき落としたりしやすいので このセルプレートはとてもよいと思う。
匿名さん 岩手県 教職員塩酸と炭酸水を一度にできるのは とてもよい。試験管立ては、倒したり、運ぶとき落としたりしやすいので このセルプレートはとてもよいと思う。
匿名さん
岩手県 教職員
透明なので下に色々おいて比較できるのが良い。この型に合った顕微鏡などがあると観察などがやしやすそう。
匿名さん 岩手県 教職員透明なので下に色々おいて比較できるのが良い。この型に合った顕微鏡などがあると観察などがやしやすそう。
匿名さん
岩手県 教職員
班各に手軽に実験が行えそうで良いと思った。下に名前を書いた紙をおけるので、間違いが少なくなりそうで良かった。
匿名さん 岩手県 教職員班各に手軽に実験が行えそうで良いと思った。下に名前を書いた紙をおけるので、間違いが少なくなりそうで良かった。
匿名さん
岩手県 教職員
水溶液の他、発芽の観察でも使えそうだと思いました。比較しやすい穴プレートがとてもよかったです。
匿名さん 岩手県 教職員水溶液の他、発芽の観察でも使えそうだと思いました。比較しやすい穴プレートがとてもよかったです。
匿名さん
岩手県 教職員
安定していて安心して使えそうで良いと思った。
匿名さん 東京都 教職員安定していて安心して使えそうで良いと思った。
匿名さん
東京都 教職員
アメリカの学校に日本の理科教育カリキュラムの導入を行っています。その一環として高校における科学の授業の中で本実験キットを活用して金属の変化の...もっと見る
MKさん 香川県 教職員金属を変化させる水溶液(アメリカの学校における科学の授業での活用)
アメリカの学校に日本の理科教育カリキュラムの導入を行っています。その一環として高校における科学の授業の中で本実験キットを活用して金属の変化の様子を紹介しました。今回は、鉄、アルミ二ウム、亜鉛、銅、マグネシウムリボンの5種類の金属に及ぼす1Nの塩酸の影響を調べました。塩酸を加えるとただちに泡が発生するマグネシウムリボンの様子に生徒たちから一斉に驚きの声があがっていました。続いてアルミニウム、亜鉛からも泡の発生がみられ、金属の種類の違いによる反応性の違いを生徒たちは注意深く観察し一生懸命記録していました。本キットで用いて12のマルチウェルプレート内で反応させることで、ふたをおいて安全性を確保しつつ泡の発生の様子がとてもよく観察でき、また金属による反応性の違いも比較が容易でした。この授業を通じて科学担当の先生へのトレーニングもできました。その先生が続いて小学、中学で科学を担当する先生方に本実験の実施方法を伝える予定です。操作性がよく、観察しやすい本キットの活用により日本の理科教育カリキュラムがアメリカでさらに広がっていくことと期待しています。
MKさん
香川県 教職員